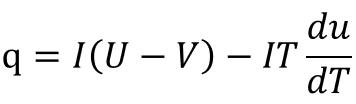 1гҖҒеҸҜйҖҶиҝҮзЁӢзҡ„е®ҡд№үеҸҜйҖҶиҝҮзЁӢжҳҜжҢҮзі»з»ҹзҠ¶жҖҒеҸ‘з”ҹж”№еҸҳеҗҺеҸҜд»ҘжІҝеҺҹи·Ҝеҫ„иҝ”еӣһпјҢдҪҝзі»з»ҹе’ҢзҺҜеўғеқҮжҒўеӨҚеҲ°еҺҹзҠ¶пјҢдё”дёҚеј•иө·д»»дҪ•еҸҳеҢ–зҡ„иҝҮзЁӢпјҢеҸҚд№ӢпјҢеҰӮжһңз”Ёд»»дҪ•ж–№жі•йғҪдёҚиғҪдҪҝзі»з»ҹе’ҢзҺҜеўғе®Ңе…ЁеӨҚеҺҹпјҢеҲҷз§°дёәдёҚеҸҜйҖҶиҝҮзЁӢгҖӮеҸҜйҖҶиҝҮзЁӢжҳҜдёҖдёӘе…·жңүеҮҶйқҷжҖҒпјҢж— иҖ—ж•Јзҡ„зҗҶжғіиҝҮзЁӢпјҢд»ҘдёӢеӣҫдёәдҫӢпјҢе…¶дёӯеҶ°еҠ зғӯиҪ¬еҢ–жҲҗж°ҙпјҢж°ҙж”ҫзғӯеҸҲеҸҳжҲҗеҶ°пјҢе·§е…ӢеҠӣеӣәдҪ“еҠ зғӯеҸҳжҲҗж¶ІдҪ“пјҢж¶ІдҪ“еҶ·еҚҙеҸҳжҲҗе·§е…ӢеҠӣеӣәдҪ“пјҢиҝҷдәӣиҝҮзЁӢеҸҜи®ӨдёәеҸҜйҖҶиҝҮзЁӢпјҢиҖҢеҜ№дәҺйёЎиӣӢеҸҳжҲҗз…ҺиӣӢпјҢжңЁжҹҙзҒ«зғ§иҝҷзұ»иҝҮзЁӢжҳҜдёҚиғҪзӣёдә’иҪ¬еҢ–зҡ„пјҢеҸҜи®ӨдёәжҳҜйқһеҸҜйҖҶиҝҮзЁӢгҖӮ
1гҖҒеҸҜйҖҶиҝҮзЁӢзҡ„е®ҡд№үеҸҜйҖҶиҝҮзЁӢжҳҜжҢҮзі»з»ҹзҠ¶жҖҒеҸ‘з”ҹж”№еҸҳеҗҺеҸҜд»ҘжІҝеҺҹи·Ҝеҫ„иҝ”еӣһпјҢдҪҝзі»з»ҹе’ҢзҺҜеўғеқҮжҒўеӨҚеҲ°еҺҹзҠ¶пјҢдё”дёҚеј•иө·д»»дҪ•еҸҳеҢ–зҡ„иҝҮзЁӢпјҢеҸҚд№ӢпјҢеҰӮжһңз”Ёд»»дҪ•ж–№жі•йғҪдёҚиғҪдҪҝзі»з»ҹе’ҢзҺҜеўғе®Ңе…ЁеӨҚеҺҹпјҢеҲҷз§°дёәдёҚеҸҜйҖҶиҝҮзЁӢгҖӮеҸҜйҖҶиҝҮзЁӢжҳҜдёҖдёӘе…·жңүеҮҶйқҷжҖҒпјҢж— иҖ—ж•Јзҡ„зҗҶжғіиҝҮзЁӢпјҢд»ҘдёӢеӣҫдёәдҫӢпјҢе…¶дёӯеҶ°еҠ зғӯиҪ¬еҢ–жҲҗж°ҙпјҢж°ҙж”ҫзғӯеҸҲеҸҳжҲҗеҶ°пјҢе·§е…ӢеҠӣеӣәдҪ“еҠ зғӯеҸҳжҲҗж¶ІдҪ“пјҢж¶ІдҪ“еҶ·еҚҙеҸҳжҲҗе·§е…ӢеҠӣеӣәдҪ“пјҢиҝҷдәӣиҝҮзЁӢеҸҜи®ӨдёәеҸҜйҖҶиҝҮзЁӢпјҢиҖҢеҜ№дәҺйёЎиӣӢеҸҳжҲҗз…ҺиӣӢпјҢжңЁжҹҙзҒ«зғ§иҝҷзұ»иҝҮзЁӢжҳҜдёҚиғҪзӣёдә’иҪ¬еҢ–зҡ„пјҢеҸҜи®ӨдёәжҳҜйқһеҸҜйҖҶиҝҮзЁӢгҖӮ
 3гҖҒеҸҜйҖҶзғӯе’ҢдёҚеҸҜйҖҶзғӯзҡ„жҺЁеҜјеҜ№дәҺдёҖдёӘеҸҜйҖҶиҝҮзЁӢпјҢз”өеҠҹе’ҢеҜ№еӨ–еҸҜеҒҡзҡ„жңҖеӨ§еҠҹзӣёзӯүпјҢWз”ө=-zFE=в–іrGmпјӣжңүе…¬ејҸ
3гҖҒеҸҜйҖҶзғӯе’ҢдёҚеҸҜйҖҶзғӯзҡ„жҺЁеҜјеҜ№дәҺдёҖдёӘеҸҜйҖҶиҝҮзЁӢпјҢз”өеҠҹе’ҢеҜ№еӨ–еҸҜеҒҡзҡ„жңҖеӨ§еҠҹзӣёзӯүпјҢWз”ө=-zFE=в–іrGmпјӣжңүе…¬ејҸ  еҸҜд»Ҙеҫ—еҲ°зҶөеҸҳдёҺжё©зҶөзі»ж•°зҡ„е…ізі»
еҸҜд»Ҙеҫ—еҲ°зҶөеҸҳдёҺжё©зҶөзі»ж•°зҡ„е…ізі»  еҪ“з”өжұ зҡ„зҶөеҸҳеӨ§дәҺ0ж—¶пјҢе…¶жё©зҶөзі»ж•°еӨ§дәҺ0пјҢиҜҙжҳҺжё©еәҰеҚҮй«ҳпјҢз”өжұ зҡ„ејҖи·Ҝз”өеҺӢеҚҮй«ҳпјӣеҪ“з”өжұ зҡ„зҶөеҸҳе°ҸдәҺ0ж—¶пјҢе…¶жё©зҶөзі»ж•°е°ҸдәҺ0пјҢиҜҙжҳҺйҡҸжё©еәҰеҚҮй«ҳпјҢз”өжұ зҡ„ејҖи·Ҝз”өеҺӢеҸҚиҖҢйҷҚдҪҺпјӣеҪ“з”өжұ зҡ„зҶөеҸҳзӯүдәҺ0ж—¶пјҢе…¶жё©зҶөзі»ж•°зӯүдәҺ0пјҢз”өжұ зҡ„ејҖи·Ҝз”өеҺӢдёҚйҡҸжё©еәҰзҡ„еҸҳеҢ–иҖҢеҸҳеҢ–гҖӮ еҸҜйҖҶзғӯе°ұеҸҜиЎЁзӨә
еҪ“з”өжұ зҡ„зҶөеҸҳеӨ§дәҺ0ж—¶пјҢе…¶жё©зҶөзі»ж•°еӨ§дәҺ0пјҢиҜҙжҳҺжё©еәҰеҚҮй«ҳпјҢз”өжұ зҡ„ејҖи·Ҝз”өеҺӢеҚҮй«ҳпјӣеҪ“з”өжұ зҡ„зҶөеҸҳе°ҸдәҺ0ж—¶пјҢе…¶жё©зҶөзі»ж•°е°ҸдәҺ0пјҢиҜҙжҳҺйҡҸжё©еәҰеҚҮй«ҳпјҢз”өжұ зҡ„ејҖи·Ҝз”өеҺӢеҸҚиҖҢйҷҚдҪҺпјӣеҪ“з”өжұ зҡ„зҶөеҸҳзӯүдәҺ0ж—¶пјҢе…¶жё©зҶөзі»ж•°зӯүдәҺ0пјҢз”өжұ зҡ„ејҖи·Ҝз”өеҺӢдёҚйҡҸжё©еәҰзҡ„еҸҳеҢ–иҖҢеҸҳеҢ–гҖӮ еҸҜйҖҶзғӯе°ұеҸҜиЎЁзӨә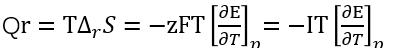 е……ж”ҫз”өиҝҮзЁӢзҡ„еҸҜйҖҶзғӯз¬ҰеҸ·жҳҜзӣёеҸҚзҡ„пјҢеҰӮжһңеҜ№дәҺе……з”өиҝҮзЁӢдёәеҗёзғӯзҡ„иҜқпјҢйӮЈд№Ҳж”ҫз”өиҝҮзЁӢеә”иҜҘдёәж”ҫзғӯиҝҮзЁӢгҖӮеҜ№дәҺдёҖдёӘйқһеҸҜйҖҶиҝҮзЁӢпјҢ з”өеҠҹWir=-zFVпјҢVиЎЁзӨәдёәз”өжұ зҡ„е®һйҷ…з”өеҺӢжңүзғӯеҠӣеӯҰ第дёҖе®ҡеҫӢеҸҜзҹҘпјҢеҸҜйҖҶиҝҮзЁӢзҡ„зғӯе’ҢеҠҹзӯүдәҺйқһеҸҜйҖҶиҝҮзЁӢзҡ„зғӯе’ҢеҠҹд№Ӣе’Ңпјӣд№ҹе°ұжҳҜйқһеҸҜйҖҶзғӯ
е……ж”ҫз”өиҝҮзЁӢзҡ„еҸҜйҖҶзғӯз¬ҰеҸ·жҳҜзӣёеҸҚзҡ„пјҢеҰӮжһңеҜ№дәҺе……з”өиҝҮзЁӢдёәеҗёзғӯзҡ„иҜқпјҢйӮЈд№Ҳж”ҫз”өиҝҮзЁӢеә”иҜҘдёәж”ҫзғӯиҝҮзЁӢгҖӮеҜ№дәҺдёҖдёӘйқһеҸҜйҖҶиҝҮзЁӢпјҢ з”өеҠҹWir=-zFVпјҢVиЎЁзӨәдёәз”өжұ зҡ„е®һйҷ…з”өеҺӢжңүзғӯеҠӣеӯҰ第дёҖе®ҡеҫӢеҸҜзҹҘпјҢеҸҜйҖҶиҝҮзЁӢзҡ„зғӯе’ҢеҠҹзӯүдәҺйқһеҸҜйҖҶиҝҮзЁӢзҡ„зғӯе’ҢеҠҹд№Ӣе’Ңпјӣд№ҹе°ұжҳҜйқһеҸҜйҖҶзғӯ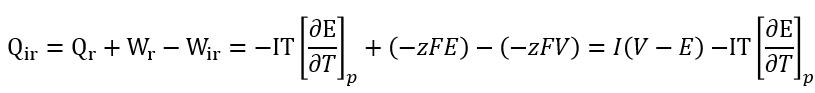
жӯӨж—¶жҲ‘们еҶҚзңӢиҝҷдёӘе…¬ејҸдёҺbernadiж–№зЁӢе®Ңе…ЁдёҖиҮҙпјҢе…¬ејҸзҡ„第дёҖйЎ№иЎЁзӨәз”ұдәҺжһҒеҢ–дә§з”ҹзҡ„зғӯпјҢ第дәҢйЎ№иЎЁзӨәдёәз”өжұ еҸҜйҖҶиҝҮзЁӢдә§з”ҹзҡ„зғӯпјҢеҪ“з”өжөҒжҜ”иҫғе°Ҹж—¶пјҢ第дёҖйЎ№еҚ жҜ”иҫғе°ҸпјҢеҸҜйҖҶзғӯжҳҫи‘—пјҢеҪ“з”өжөҒжҜ”иҫғеӨ§ж—¶пјҢжһҒеҢ–зғӯе°ұжҜ”иҫғжҳҫи‘—пјҢж— и®әе……ж”ҫз”өиҝҮзЁӢпјҢз”өжұ еқҮиЎЁзҺ°дёәеҜ№еӨ–з•Ңж”ҫзғӯгҖӮ
