提示:点击上方"蓝色字"↑可快速关注我们
2017年10月包括Apple、Fitbit、Samsung、Johnson & Johnson等9家厂商参与美国FDA推行的Software Precertification(Pre-Cert) Program试点项目,获得「预认证(Pre-Cert)」资格的数位医疗开发商,将有机会能透过更精简的审查程序将其较低风险的设备推进市场。
2019年1月7日FDA公布Pre-Cert Program最新1.0版本,FDA希望在现有监管架构下采取行动,并在简化的审查方式下,有效确保此类新技术产品在实际应用上的安全性和有效性。
FDA试以De Novo Pathway作为Pre-Cert Program监管框架
Pre-Cert Program 1.0版已是第三次更新,此版主要概述该计划将利用针对创新、市场未有可比对产品、低、中级风险等医材上市审查途径(De Novo Pathway)进行软件医材(Software as Medical Device)审查,过去如Apple Watch的ECG App、第一个用于检测轻度糖尿病视网膜病变的IDx-DR人工智能软件医材,便是透过De Novo Pathway审查通过。
依De Novo途径提交申请的数位医疗开发商,须先满足质量系统法规(Quality System Regulation)要求(包括软件设计、验证与生产过程等),此要求亦可成为该厂商是否具卓越的质量与组织文化的「预认证」资格评估之一,FDA将依此资格为其特定设备进行量身定制的上市审查流程,可减少开发商提交审查信息与时间。
FDA将启动大规模试验,以扩大数位医疗发展机会
数位医疗产品评估方式与传统医疗设备不同,其中最大差异就是软件需经常更新,因此Pre-Cert Program重点关注软件设计、验证、标准维护与上市后获取真实世界数据的能力,Apple和Fitbit等厂商皆向FDA提供有关软件和数位消费电子产品的开发、测试与维护等见解,以及如何收集真实世界数据的经验,使FDA能据此建构更符合软件医材领域迅速发展特性的监管架构。
FDA将于2019年启动大规模试验,并计划对以简化版De Novo Pathway进行审查的Pre-Cert Program与以传统De Novo Pathway程序的审核流程进行平行比较,用以评估Pre-Cert Program的审查是否能把关产品安全性和有效性,以确保公共健康。
未来若此监管框架能顺利实施,已参与试点计划的科技厂如Apple、Samsung与Fitbit,在强大的品牌和消费者高接受度下,或将抢先占有数位医疗市场份额。
Source:拓墣产业研究
图片声明:封面图片来自正版图片库:拍信网。
友情提示:由于微信公众号改版,大家可能无法及时获取我们的推送。
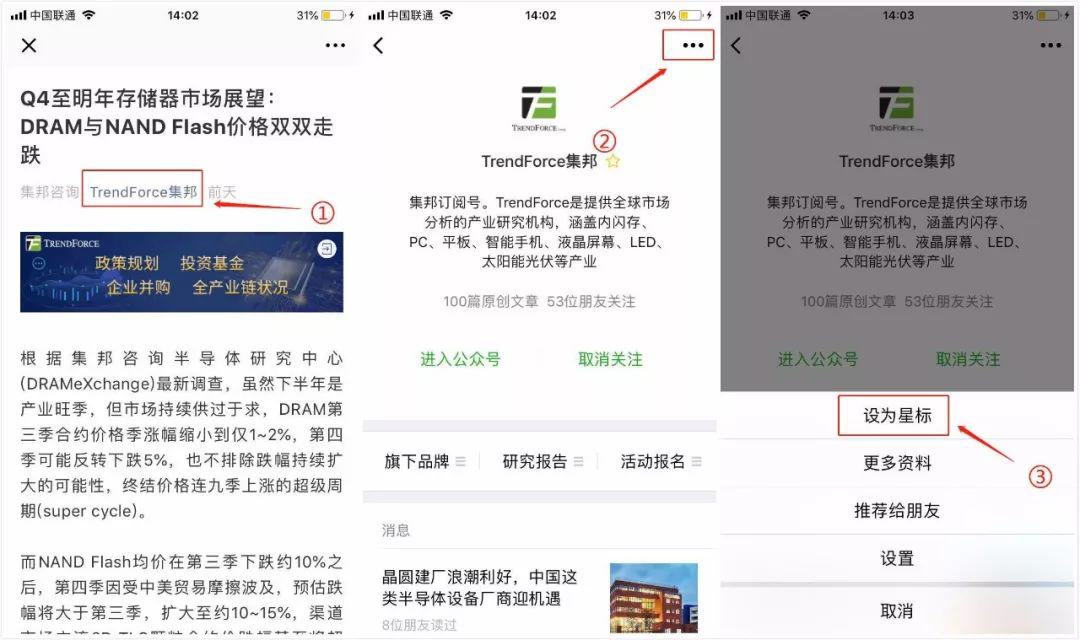
现在只需三步,即可第一时间获取科技产业最新动态与市场研究,1、点击标题下方“TrendForce集邦”;2、点击公众号右上角“...”;3、将公众号设为星标。
PS:如果是老版本,可在第三步的时候点击“置顶公众号”。
*
*
*
*
*



