在锂离子电池的电化学体系中,极化是指电极电位偏离平衡电位的现象,而去极化是指电极电位回归平衡电位的现象,其中我们需要特殊关注的有两种特殊的极化类型,如下图所示,理想极化电极(②)和理想非极化电极(①),理想极化电极是指在其电极上加上微小的电流,就会引起极大的电压变化,或者说只有加载极大的电压才会激发出很小的电流;理想非极化电极是指无论加载多大的电流,都不会轻易引起电位的改变,说明该电极的可逆性好,适合做参比电极,能够在变化的环境中保持稳定的电位值。对于研究的电极材料或电芯产品来说,其极化特性都是处于两者之间的阴影部分,且希望往理想非极化电极靠近,但是也不希望达到理想非极化电极状态,为什么?
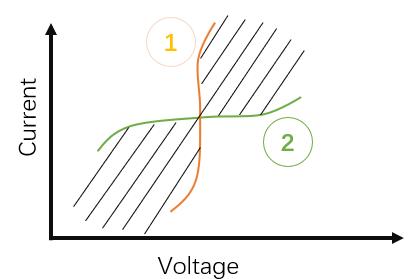
理想非极化电极上的反应是平衡态的,无方向的净反应。以Li+ + e-=Li为例,如果在电极上沉积的Li和析出的Li+一样多,那么就不会有Li+的定向移动,无法在电解液中形成Li+的离子回路,电池也就无法实现充放电过程,这样的一个电池是毫无意义的。这就像有一个明显的短板的水桶一样,液面不受加水的流速(等效于电流)的变化而变化,加多少水就会流出去多少水(氧化产物和还原反应物生成速率一样),这样的水桶也是无意义的!
 锂电池的电极有极化才有意义。我们只需要在外界增加额外的能量,比如说过电位或者大电流,就会导致电极的电化学反应发生偏移平衡状态,恰好是极化的产生引起了电极净反应的持续进行,使得电极发生脱嵌锂反应,完成电能和化学能的相互转换。
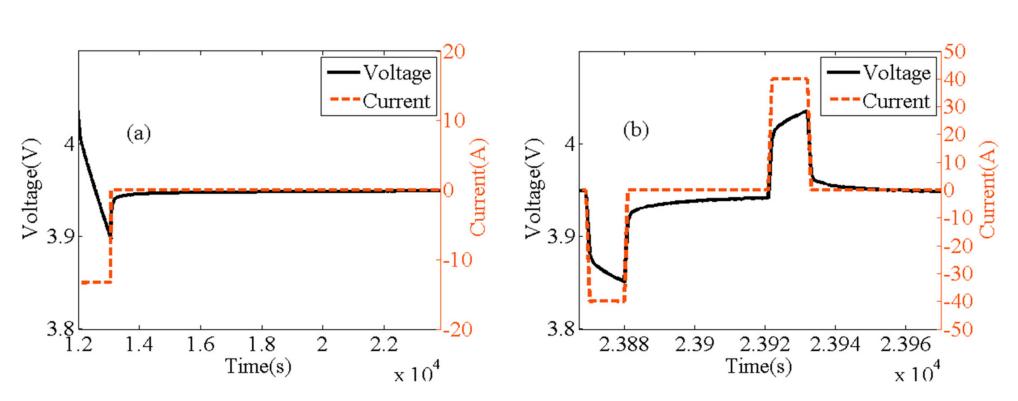
锂电池的电极有极化才有意义。我们只需要在外界增加额外的能量,比如说过电位或者大电流,就会导致电极的电化学反应发生偏移平衡状态,恰好是极化的产生引起了电极净反应的持续进行,使得电极发生脱嵌锂反应,完成电能和化学能的相互转换。电极产生极化的原因是什么?我们通过了解电极极化的类型来介绍极化产生的原理,在常规的研究中,一般将电极极化根据响应时间的长短分成三种,欧姆极化(IR drop),电化学极化(Activation polarisation)和浓差极化(Conc polarisation)。
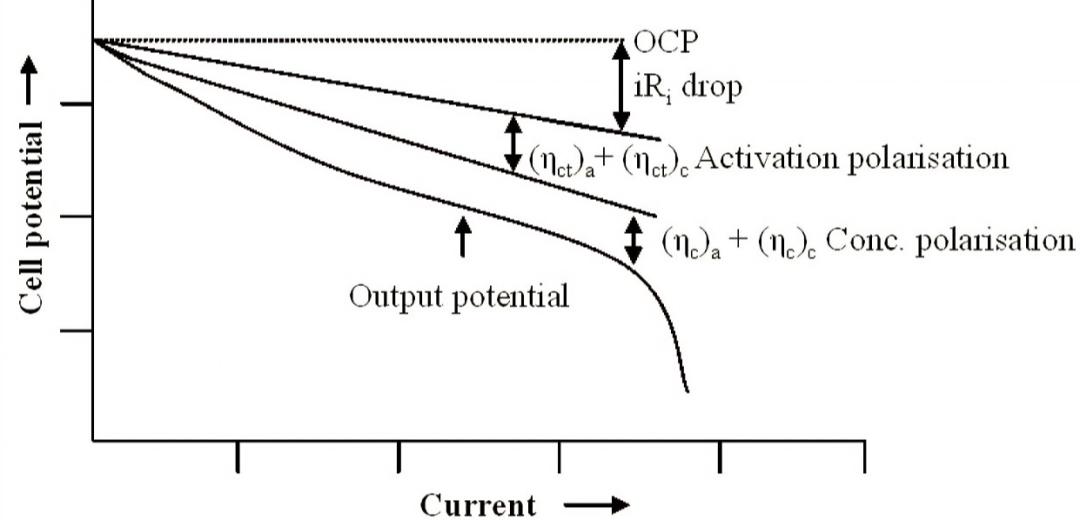
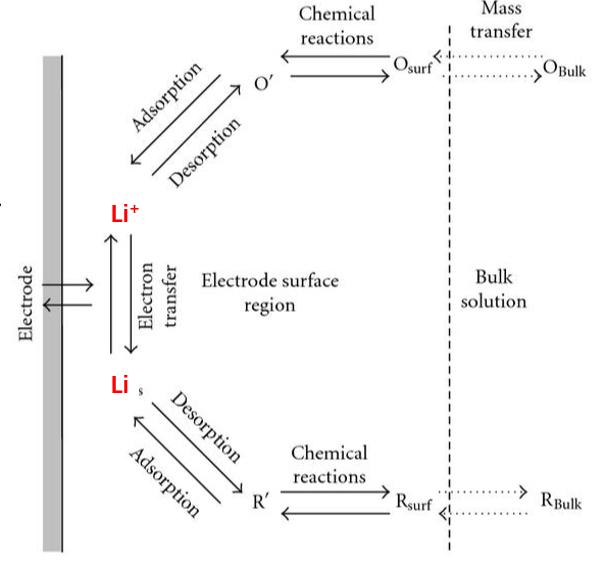
虽然电极极化是不可避免且有意义的,但是在实际过程中,我们还是希望电极的极化越来越小越好,这样电池的倍率性能才能更好,新能源车才能跑的更快更远。
